Oxidation
Die Oxidation ist ein zentrales Verfahren der Wasseraufbereitung und umfasst eine Vielzahl redoxchemischer Prozesse, die auf der Übertragung von Elektronen beruhen. Sie wird eingesetzt, um gelöste anorganische oder organische Stoffe in höherwertige Oxidationsstufen zu überführen, wodurch sie entweder in löslicher, stabiler Form weniger problematisch sind oder als schwerlösliche Verbindungen ausgefällt und anschließend filtriert werden können.
Die Oxidation dient in der Praxis mehreren Zielsetzungen: der Entfernung von Eisen, Mangan, Ammonium und Schwefelwasserstoff; der Reduktion organischer Spurenstoffe; der Desinfektion; sowie der Vorbereitung nachgeschalteter Prozesse wie Flockung, Filtration oder Adsorption.
Chemische und elektrochemische Grundlagen
Redoxreaktionen in der Wasseraufbereitung folgen den thermodynamischen Gesetzmäßigkeiten der Standard-Redoxpotenziale (E⁰). Ein Oxidationsmittel ist umso wirksamer, je höher sein Redoxpotenzial im Vergleich zum Zielsubstrat liegt.
Die Reaktionsgeschwindigkeit hängt von der Art des Oxidationsmittels, dem pH-Wert und der Temperatur ab. Während Sauerstoff bei Eisen noch ausreichend wirksam ist, erfordert die Oxidation von Mangan deutlich stärkere Oxidationsmittel oder einen höheren pH-Wert.
Relevante Oxidationsmittel
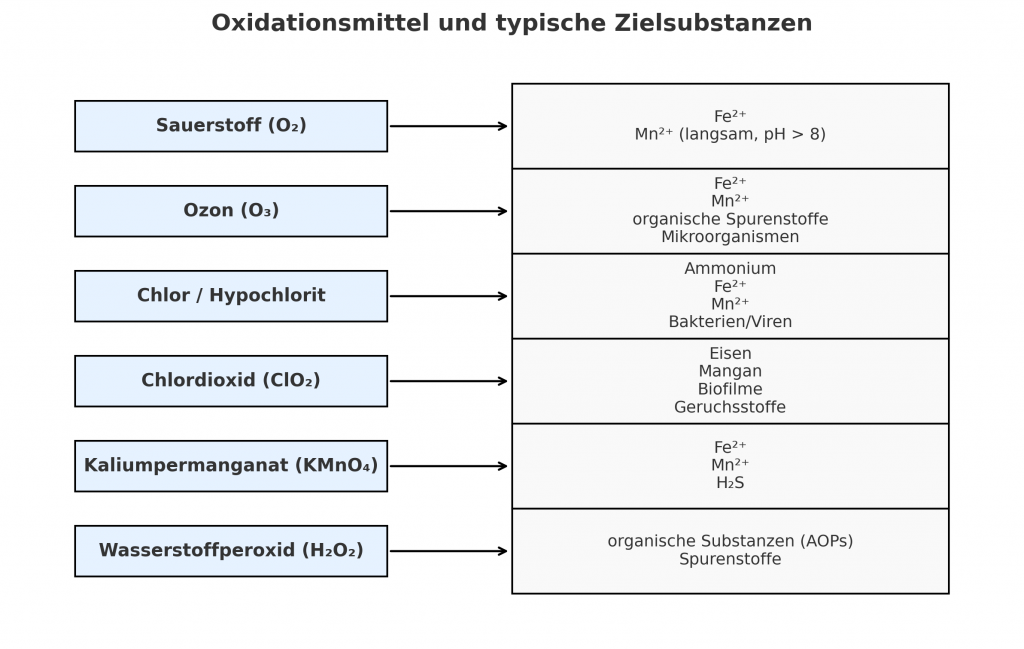
- Sauerstoff (O₂): preiswert, universell verfügbar, kinetisch jedoch langsam. Insbesondere für Eisen geeignet, Mangan nur eingeschränkt.
- Ozon (O₃): starkes Oxidationsmittel, wirksam gegen Metalle, organische Stoffe und Mikroorganismen. Bildung von Bromat bei bromidhaltigem Wasser kritisch.
- Chlor (Cl₂) und Hypochlorit (NaOCl): klassische Oxidations- und Desinfektionsmittel, besonders gegen Ammonium und Mikroorganismen. Nebenproduktbildung (THM, AOX) problematisch.
- Chlordioxid (ClO₂): selektiver, weniger Nebenprodukte, wirksam gegen Eisen, Mangan und Biofilme.
- Kaliumpermanganat (KMnO₄): geeignet zur Oxidation von Fe²⁺, Mn²⁺ und H₂S; bildet MnO₂ als Fällungsprodukt.
- Wasserstoffperoxid (H₂O₂): in Kombination mit UV oder Ozon Grundlage für AOPs, erzeugt hochreaktive Hydroxylradikale.
Prozessführung und kinetische Aspekte
Die Effizienz der Oxidation hängt von der optimalen Prozessführung ab. Entscheidend sind:
- pH-Wert: Oxidationsreaktionen verlaufen pH-abhängig. Eisen wird bei pH > 6,5 schnell oxidiert, Mangan hingegen erst oberhalb von pH 8. Chlor verliert bei steigendem pH an Wirksamkeit, da HOCl in OCl⁻ übergeht.
- Reaktionszeit: Kontaktstrecken und Mischbehälter müssen auf die Reaktionskinetik abgestimmt sein. Langsame Reaktionen (z. B. O₂-Oxidation von Mn²⁺) erfordern lange Verweilzeiten oder Katalyse.
- Dosierung: In der Regel wird ein stöchiometrischer Überschuss an Oxidationsmittel eingesetzt, um eine vollständige Umsetzung zu gewährleisten.
- Katalyse: Filtermaterialien wie Greensand oder mit MnO₂ beschichtete Medien beschleunigen die Reaktionen und ermöglichen eine kombinierte Adsorption und Oxidation.
- Nebenprodukte: Prozessführung muss Nebenproduktbildung minimieren, z. B. THM bei Chlorung oder Bromat bei Ozonierung.
Anwendungen in der Wasseraufbereitung
- Trinkwasseraufbereitung: Entfernung von Eisen, Mangan, Ammonium und H₂S; Reduktion von Geruchs- und Geschmacksstoffen; Desinfektion.
- Grund- und Brunnenwasser: Vorbehandlung zur Filtration, insbesondere bei hohen Fe/Mn-Gehalten.
- Abwasser: Abbau von Spurenstoffen (Pestizide, Pharmazeutika, endokrine Substanzen) über AOPs.
- Industriewasser: Oxidative Vorbehandlung zum Schutz von Kesselspeisewasser- und Kühlwassersystemen.
Oxidationsmittel in der Wasseraufbereitung
Die in der Praxis eingesetzten Oxidationsmittel unterscheiden sich deutlich hinsichtlich ihres Redoxpotenzials, der bevorzugten Zielsubstanzen, der Prozessführung und möglicher Nebenprodukte.
- Sauerstoff (O₂): Mit einem Standard-Redoxpotenzial von +1,23 V ist Sauerstoff ein vergleichsweise schwaches, aber kostengünstiges Oxidationsmittel. Er eignet sich primär zur Oxidation von Eisen (Fe²⁺ → Fe³⁺) und kann bei hohen pH-Werten auch Mangan (Mn²⁺ → MnO₂) oxidieren, allerdings nur sehr langsam. In der Regel wird Sauerstoff durch einfache Belüftung eingebracht, häufig in Kombination mit katalytisch aktiven Filtermaterialien. Nebenprodukte entstehen hierbei keine.
- Ozon (O₃): Mit einem Standardpotenzial von +2,07 V zählt Ozon zu den stärksten in der Wasseraufbereitung eingesetzten Oxidationsmitteln. Es oxidiert Eisen, Mangan, Schwefelwasserstoff, organische Spurenstoffe und wirkt gleichzeitig desinfizierend gegenüber Mikroorganismen. Da Ozon eine kurze Halbwertszeit besitzt, muss es vor Ort erzeugt und sofort eingesetzt werden. Kritisch ist die Bildung von Bromat, insbesondere bei bromidhaltigem Rohwasser.
- Chlor (Cl₂) und Hypochlorit (NaOCl): Mit einem Potenzial von etwa +1,36 V (HOCl) sind Chlor und Hypochlorit vielseitige Oxidations- und Desinfektionsmittel. Sie werden zur Oxidation von Ammonium, Eisen, Mangan und organischen Stoffen eingesetzt und sind hochwirksam gegen Bakterien und Viren. Die Wirksamkeit ist pH-abhängig, da HOCl (stark wirksam) bei steigendem pH zunehmend in OCl⁻ (schwächer wirksam) übergeht. Nachteilig ist die Bildung halogenierter Nebenprodukte, insbesondere Trihalogenmethane (THM) und AOX.
- Chlordioxid (ClO₂): Mit einem Potenzial von ca. +0,95 V ist Chlordioxid schwächer als Ozon oder Chlor, wirkt jedoch selektiver. Es wird zur Oxidation von Eisen, Mangan, Biofilmen und Geruchsstoffen eingesetzt. Der große Vorteil ist seine geringere pH-Abhängigkeit und die deutlich reduzierte Bildung problematischer Nebenprodukte. Allerdings können Chlorit- und Chlorat-Rückstände entstehen.
- Kaliumpermanganat (KMnO₄): Mit einem Redoxpotenzial von +1,70 V ist Kaliumpermanganat ein starkes Oxidationsmittel, das besonders für die Entfernung von Eisen, Mangan und Schwefelwasserstoff eingesetzt wird. Es bildet dabei feste MnO₂-Flocken, die im Filter abgeschieden werden können. Vorteil ist die einfache Handhabbarkeit, nachteilig ist die mögliche violette Färbung des Wassers bei Überdosierung.
Wasserstoffperoxid (H₂O₂): Mit einem Standardpotenzial von +1,77 V wirkt Wasserstoffperoxid moderat oxidierend. In Kombination mit UV-Strahlung oder Ozon werden jedoch hochreaktive Hydroxylradikale gebildet (Advanced Oxidation Processes, AOPs), die nahezu alle organischen Substanzen unspezifisch abbauen können. Nebenprodukte sind hier kaum relevant, da Wasserstoffperoxid zu Wasser und Sauerstoff zerfällt.
Die Oxidation ist eines der vielseitigsten Aufbereitungsverfahren in der Wassertechnik. Ihre Wirksamkeit beruht auf der gezielten Auswahl geeigneter Oxidationsmittel, abgestimmt auf die Wasserzusammensetzung, den pH-Wert, die erforderliche Reaktionsgeschwindigkeit und die Vermeidung unerwünschter Nebenprodukte.
Für Experten ist entscheidend, Oxidationsprozesse nicht isoliert, sondern als integralen Bestandteil der Gesamtaufbereitungskette zu betrachten. Erst in Kombination mit Filtration, Adsorption und biologischen Verfahren entfalten sie ihr volles Potenzial. Angesichts der zunehmenden Herausforderungen durch Spurenstoffe und strenger werdender Grenzwerte wird die Oxidation in der Zukunft weiter an Bedeutung gewinnen.
